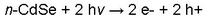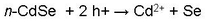La pile photovoltaïque électrochimique
Constitution
Des recherches effectuées au milieu des années 1970 ont permis de mettre en évidence l’effet photoélectrochimique, c’est-à-dire que l’effet photovoltaïque peut être obtenu en mettant un semi-conducteur en contact avec un milieu électrolytique contenant un couple redox (mélange d’espèces réduites et oxydées liées par un équilibre d’oxydoréduction), d’où l’implication d’un processus électrochimique.
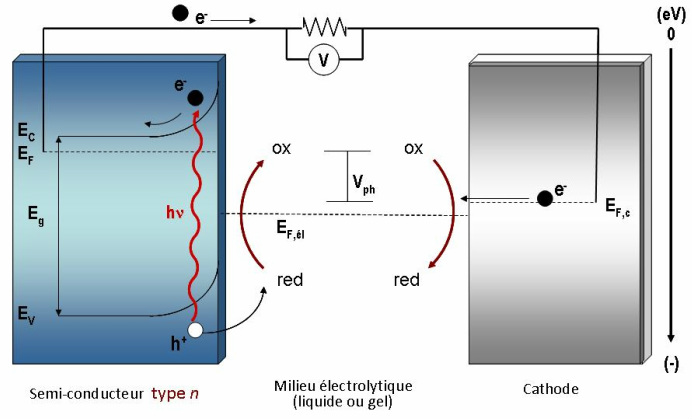
Ces processus électrochimiques s’effectuent via le couple redox qui assure le transport des charges d’une électrode à l’autre. Le dispositif permettant de convertir directement l’énergie solaire en électricité en exploitant l’effet décrit ci-dessus s’appelle une cellule photovoltaïque électrochimique (CPE). Une CPE est constituée principalement de trois composantes, soit un semi-conducteur de type n ou p, un milieu électrolytique et une contre-électrode. La Figure 1 montre le principe général de fonctionnement d’une CPE employant un semi-conducteur de type n.
Figure 1 Schéma explicatif du fonctionnement d’une CPE générale de configuration semi-conducteur de type n || milieu électrolytique avec espèces redox || cathode. Les symboles sont décrits dans le fonctionnement.
Retour en haut de la page
Description du fonctionnement
Le cycle débute par l’illumination du semi-conducteur via la cathode et le milieu électrolytique. Si l’énergie des photons (hv) est égale ou supérieure à l’énergie de la bande interdite du semi-conducteur (Eg), une paire électron-trou (e-/h+) est générée. Les électrons sont promus de la bande de valence (Ev) à la bande de conduction (Ec). Les trous (h+) laissés par la promotion des électrons se déplacent vers l’interface de l’anode et du milieu électrolytique où l’espèce réduite (red) du couple redox est photo-oxydée. Les espèces oxydées (ox) se rendent ensuite vers la cathode, par migration et/ou diffusion dépendant si l’espèce est chargée ou neutre, où elles sont réduites par les électrons (e-) provenant du circuit extérieur.
Un photocourant et un photovoltage (Vph), déterminés par la différence entre le niveau de Fermi du semi-conducteur (EF) et celui de la cathode (EF, cathode), sont ainsi générés sans qu’aucune modification chimique ne soit impliquée au niveau du milieu électrolytique. Sous une illumination très intense, le niveau de Fermi de la cathode rejoint celui du milieu électrolytique (EF, él). On atteint alors le photovoltage maximal de la pile qui correspondra à la différence des niveaux de Fermi du semi-conducteur et du milieu électrolytique.
Retour en haut de la page
Historique
La première cellule photovoltaïque électrochimique fut développée par Gerischer et Goberecht en 1976 et présentait la configuration suivante : n-CdSe || ferricyanure, ferrocyanure || verre conducteur (ITO) [1]. Celle-ci était basée sur la jonction entre le semi-conducteur monocristallin de type n CdSe et un milieu électrolytique aqueux contenant le couple redox ferricyanure/ferrocyanure. La cathode quasi-transparente était un verre recouvert d’un mince film de SnO2 dopé à l’indium (ITO), rendant ce dernier conducteur.
Rendement
Le rendement de conversion d’énergie de cette pile se situait à 5% en début de fonctionnement, mais diminuait très rapidement jusqu’à l’arrêt complet de conversion de la pile. Cela s’explique par l’apparition rapide d’un phénomène appelé photo-corrosion qui se produisit à la surface du semi-conducteur, illustré par les réactions suivantes :
Retour en haut de la page
Description du fonctionnement
Le cycle débute par l’illumination du semi-conducteur via la cathode et le milieu électrolytique. Si l’énergie des photons (hv) est égale ou supérieure à l’énergie de la bande interdite du semi-conducteur (Eg), une paire électron-trou (e-/h+) est générée. Les électrons sont promus de la bande de valence (Ev) à la bande de conduction (Ec). Les trous (h+) laissés par la promotion des électrons se déplacent vers l’interface de l’anode et du milieu électrolytique où l’espèce réduite (red) du couple redox est photo-oxydée. Les espèces oxydées (ox) se rendent ensuite vers la cathode, par migration et/ou diffusion dépendant si l’espèce est chargée ou neutre, où elles sont réduites par les électrons (e-) provenant du circuit extérieur.
Un photocourant et un photovoltage (Vph), déterminés par la différence entre le niveau de Fermi du semi-conducteur (EF) et celui de la cathode (EF, cathode), sont ainsi générés sans qu’aucune modification chimique ne soit impliquée au niveau du milieu électrolytique. Sous une illumination très intense, le niveau de Fermi de la cathode rejoint celui du milieu électrolytique (EF, él). On atteint alors le photovoltage maximal de la pile qui correspondra à la différence des niveaux de Fermi du semi-conducteur et du milieu électrolytique.
Retour en haut de la page
Historique
La première cellule photovoltaïque électrochimique fut développée par Gerischer et Goberecht en 1976 et présentait la configuration suivante : n-CdSe || ferricyanure, ferrocyanure || verre conducteur (ITO) [1]. Celle-ci était basée sur la jonction entre le semi-conducteur monocristallin de type n CdSe et un milieu électrolytique aqueux contenant le couple redox ferricyanure/ferrocyanure. La cathode quasi-transparente était un verre recouvert d’un mince film de SnO2 dopé à l’indium (ITO), rendant ce dernier conducteur.
Rendement
Le rendement de conversion d’énergie de cette pile se situait à 5% en début de fonctionnement, mais diminuait très rapidement jusqu’à l’arrêt complet de conversion de la pile. Cela s’explique par l’apparition rapide d’un phénomène appelé photo-corrosion qui se produisit à la surface du semi-conducteur, illustré par les réactions suivantes :
Sous illumination hv, les trous (h+), laissés par l’excitation des électrons passant de la bande de valence à la bande de conduction du semi-conducteur, viennent oxyder préférentiellement ce matériau photo-actif, plus rapidement que les espèces réduites de ferrocyanure en solution. Ce phénomène entraîne une dissolution graduelle du cadmium et la formation d’une couche résistive de sélénium (Se) en surface qui conduit, à court terme, à une diminution drastique des performances de la pile.
Retour en haut de la page
Caractéristiques de la pile
Afin de contrer ce problème, des milieux électrolytiques contenant un couple redox réagissant plus rapidement aux électrodes ont été étudiés. L’utilisation des polysulfures inorganiques a, par exemple, démontré une cinétique de réaction plus rapide aux électrodes que celle de photo-corrosion, ce qui a permis de stabiliser le semi-conducteur. Ainsi, la CPE de configuration n-CdSe monocristallin || Cs2S 1 M, S 1 M, NaOH 1 M || Pt offrait un meilleur rendement de conversion, soit 9,5% [2].
Toutefois, les polysulfures sont très colorés (orange) en milieu aqueux, absorbant une partie du spectre du visible, ce qui nuit aux performances de la pile. Le milieu électrolytique, demeurant un milieu aqueux, conduisait tout de même avec le temps à la corrosion du CdSe. Des milieux non-aqueux doivent donc être employés dans ce type de pile qui possède plusieurs avantages:
i. la jonction est immédiate puisque le contact est direct entre la solution et le semi-conducteur, ce dernier étant bien mouillé par la solution;
ii. la technologie dite en couche mince permet d’employer des films semi-conducteurs de faible épaisseur (0.003 à 0.010 mm) si l’on utilise des matériaux dont le coefficient d’absorption est élevé, permettant ainsi de diminuer les coûts du dispositif reliés aux matériaux;
iii. des piles flexibles peuvent être envisagées si l’on utilise un substrat de plastique conducteur pour déposer les films;
iv. il est possible de moduler le photovoltage en employant un éventail de semi-conducteurs et divers milieux électrolytiques;
v. les applications de ce dispositif sont multiples. Il pourrait, par exemple, être installé sur le toit ou les fenêtres des maisons, recouvrir des voitures (recharge de la batterie) et même être appliqué sur des vêtements.
Bibliographie
[1]. Gerischer, H. et J. Goberecht, Ber. Bunsenges. Phys. Chem., 80, 327 (1976).
[2]. Licht, S., R. Tenne, J. Flaisher et J. Manassen, J. Electrochem. Soc., 133, 52 (1986).
Retour en haut de la page
Caractéristiques de la pile
Afin de contrer ce problème, des milieux électrolytiques contenant un couple redox réagissant plus rapidement aux électrodes ont été étudiés. L’utilisation des polysulfures inorganiques a, par exemple, démontré une cinétique de réaction plus rapide aux électrodes que celle de photo-corrosion, ce qui a permis de stabiliser le semi-conducteur. Ainsi, la CPE de configuration n-CdSe monocristallin || Cs2S 1 M, S 1 M, NaOH 1 M || Pt offrait un meilleur rendement de conversion, soit 9,5% [2].
Toutefois, les polysulfures sont très colorés (orange) en milieu aqueux, absorbant une partie du spectre du visible, ce qui nuit aux performances de la pile. Le milieu électrolytique, demeurant un milieu aqueux, conduisait tout de même avec le temps à la corrosion du CdSe. Des milieux non-aqueux doivent donc être employés dans ce type de pile qui possède plusieurs avantages:
i. la jonction est immédiate puisque le contact est direct entre la solution et le semi-conducteur, ce dernier étant bien mouillé par la solution;
ii. la technologie dite en couche mince permet d’employer des films semi-conducteurs de faible épaisseur (0.003 à 0.010 mm) si l’on utilise des matériaux dont le coefficient d’absorption est élevé, permettant ainsi de diminuer les coûts du dispositif reliés aux matériaux;
iii. des piles flexibles peuvent être envisagées si l’on utilise un substrat de plastique conducteur pour déposer les films;
iv. il est possible de moduler le photovoltage en employant un éventail de semi-conducteurs et divers milieux électrolytiques;
v. les applications de ce dispositif sont multiples. Il pourrait, par exemple, être installé sur le toit ou les fenêtres des maisons, recouvrir des voitures (recharge de la batterie) et même être appliqué sur des vêtements.
Bibliographie
[1]. Gerischer, H. et J. Goberecht, Ber. Bunsenges. Phys. Chem., 80, 327 (1976).
[2]. Licht, S., R. Tenne, J. Flaisher et J. Manassen, J. Electrochem. Soc., 133, 52 (1986).