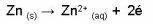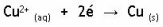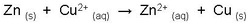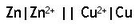La pile de Daniell

Inventée en 1836 par un chimiste britanique qui s'appelait Jonh Daniell, la pile de Daniell est souvent utilisée comme exemple pour expliquer le fonctionnement des piles chimiques [1].
Fonctionnement
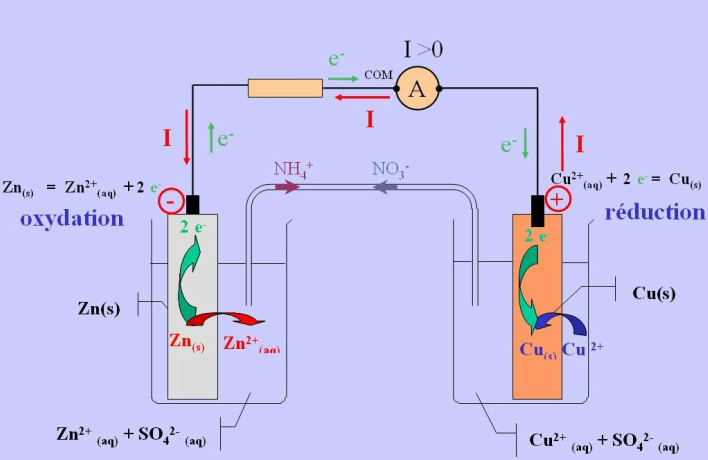
La pile de Daniell est une pile dans laquelle s'effectue une réaction d'oxydoréduction, dont l'échange d'électrons entre le zinc, servant d'anode, et le cuivre, servant de cathode, est à l'origine du courant électrique. La pile est constituée de deux compartiments dont l'un contient une solution de sulfate de zinc (ZnSO4) dans laquelle est immergée une plaque de zinc métallique. L'autre compartiment de la pile contient une solution de sulfate de cuivre (CuSO4) dans laquelle baigne une plaque métallique de cuivre.
Un pont électrolytique, fait d'ions très solubles dans l'eau, assure le transport des ions d'un compartiment à l'autre pour compléter le conductivité ionique en fermant le circuit et éviter l'accumulation de charges à chacune des électrodes. La conductivité ionique peut aussi être assurée par l'utilisation d'un verre poreux ou d'un vase en céramique permettant l'échange d'ions entre les deux solutions sans que celles-ci ne se mélangent [2].
Figure 1 Schéma de fonctionnement de la pile de Daniell [3].
Réaction d'oxydo-réduction
Dans une pile chimique comme celle de Daniell, les électrons responsables du courant électrique circulent de l'anode, qui est l'électrode de signe négatif, vers la cathode, représentant l'électrode positive. Tel qu'illustré à la Figure 1, le zinc métallique, servant d'anode, cède deux électrons pour être oxydé sous la forme de Zn chargé 2+. Ce zinc sous forme ionique passe alors en solution.
Cette réaction représente la demi-réaction d'oxydation:
Réaction d'oxydo-réduction
Dans une pile chimique comme celle de Daniell, les électrons responsables du courant électrique circulent de l'anode, qui est l'électrode de signe négatif, vers la cathode, représentant l'électrode positive. Tel qu'illustré à la Figure 1, le zinc métallique, servant d'anode, cède deux électrons pour être oxydé sous la forme de Zn chargé 2+. Ce zinc sous forme ionique passe alors en solution.
Cette réaction représente la demi-réaction d'oxydation:
Retour en haut de la page
Les électrons libérés par le zinc sont ensuite captés par la plaque de cuivre qui permet la réduction des ions de Cu chargé 2+ en solution sous forme de cuivre métallique.
Cette réaction représente la demi-réaction de réduction:
Les électrons libérés par le zinc sont ensuite captés par la plaque de cuivre qui permet la réduction des ions de Cu chargé 2+ en solution sous forme de cuivre métallique.
Cette réaction représente la demi-réaction de réduction:
Lorsque l'on combine les deux demi-réactions, on obtient la réaction globale d'oxydo-réduction qui se produit durant le fonctionnement de la pile.
Réaction globale d'oxydo-réduction:
Réaction globale d'oxydo-réduction:
Force électromotrice
La force électromotrice (FEM) de la pile, exprimée en volt, est obtenue par la différence de potentiel entre le potentiel standard de la cathode et celui de l'anode. Dans le cas de la pile de Daniell, la FEM est calculée par la différence de potentiel entre l'électrode de Zn et de Cu, ce qui correspond à 1.1 volt à 25°C.
Symbole de la pile
Chaque pile est schématisée en placant l'anode à gauche et la cathode à droite selon la convention suivante, l'anode et la cathode sont séparée par le pont électrolytique représenté par deux barres verticales (||).
Dans chaque compartiment, anodique et cathodique, les espèces chimique sont placées dans l'ordre suivant: métal, solide, gazeux, liquide ou aqueux. Chaque phase différente de matériaux est séparée par une barre verticale (|) et chaques composantes d'une même phase sont séparées par une virgule (,). Lorsque l'électrode n'est pas métallique, on utilise le platine (Pt) comme métal pour catalyser la réaction à la demi-pile puisqu'il est inerte chimiquement.
Le symbole de la pile de Daniell est :
La force électromotrice (FEM) de la pile, exprimée en volt, est obtenue par la différence de potentiel entre le potentiel standard de la cathode et celui de l'anode. Dans le cas de la pile de Daniell, la FEM est calculée par la différence de potentiel entre l'électrode de Zn et de Cu, ce qui correspond à 1.1 volt à 25°C.
Symbole de la pile
Chaque pile est schématisée en placant l'anode à gauche et la cathode à droite selon la convention suivante, l'anode et la cathode sont séparée par le pont électrolytique représenté par deux barres verticales (||).
Dans chaque compartiment, anodique et cathodique, les espèces chimique sont placées dans l'ordre suivant: métal, solide, gazeux, liquide ou aqueux. Chaque phase différente de matériaux est séparée par une barre verticale (|) et chaques composantes d'une même phase sont séparées par une virgule (,). Lorsque l'électrode n'est pas métallique, on utilise le platine (Pt) comme métal pour catalyser la réaction à la demi-pile puisqu'il est inerte chimiquement.
Le symbole de la pile de Daniell est :
Médiagraphie
[1]. Encyclopaedia Britannica, 1911.
[2]. Tournier, M. et M. Servant, Chimie 2. Les équilibres chimiques livre 2, les éditions CEC, Anjou, 1983, 259 p.
[3]. Site pédagogique de l'enseignement de la science physique de Julien Geandrot, consultation le 13 juin 2011, mise à jour le 15 mars 2011, URL de cette page: http://www.physagreg.fr/animations.php#chim.